- FR
- EN

Einfach nur vergesslich…?
Alzheimer- und andere Demenzformen gehören zu den größten Herausforderungen unserer Zeit - Geschrieben von Iris Heiermann, L&H Senior-Schadenmanager.
Alzheimer und andere Demenzformen, irreversible und fortschreitende Hirnerkrankungen, die langsam, aber sicher das menschliche Gedächtnis und grundlegende Lebensfähigkeiten zerstören, gehören zu den größten Herausforderungen für das Gesundheitswesen, denen wir heute gegenüberstehen. Schätzungen gehen davon aus, dass weltweit 55 Millionen Menschen an Demenz erkrankt sind, wovon laut dem WHO-Bericht 2023 der Anteil der Alzheimer-Erkrankungen 60-70 % beträgt. Zwar gibt es noch keine Heilung, doch die jüngsten Fortschritte in der Forschung geben Anlass zu wachsender Hoffnung.
Wie alles begann
„Ich habe mich sozusagen verloren.“ Diese Worte werden der Patientin Auguste Deter zugeschrieben, die als einer der ersten dokumentierten Fälle der Alzheimer-Erkrankung gilt. Auguste Deter war eine 51-jährige Frau, die 1901 in der Psychiatrischen Anstalt in Frankfurt am Main behandelt wurde, weil sie unter anderem an schweren Gedächtnisstörungen und Wahnvorstellungen litt. Sie konnte sich kaum an mehr als ihren Vornamen erinnern und war misstrauisch, aggressiv und weinerlich. Dr. Alois Alzheimer, ein deutscher Psychiater und Neuropathologe, wurde auf ihren Fall aufmerksam und begann, sie zu untersuchen. Alzheimer verfolgte den rapide fortschreitenden Verlauf der Erkrankung bis zu ihrem Tod im Jahr 1906.
Bei der anschließenden Untersuchung des Gehirns von Auguste Deter zeigten sich zugrunde gegangene Nervenzellen mit Bündeln faseriger Strukturen sowie Ablagerungen außerhalb der Zellen, welche später als „Neurofibrillenbündel“ und „Alzheimer-Plaques“ bezeichnet wurden.
Die Entdeckung von Alois Alzheimer war bahnbrechend, da sie einen neuen Weg zur Erforschung der Demenz eröffnete und somit die Entwicklung von Behandlungsmöglichkeiten und diagnostischen Verfahren maßgeblich beeinflusste.

[Alois Alzheimer] - Digital Collections - National Library of Medicine (nih.gov)
In den letzten Jahren hat die Alzheimer-Forschung noch einmal an Bedeutung gewonnen, da die Erkrankung durch den demographischen Wandel inzwischen von einem Randphänomen zu einem Problem geworden ist, das in der Mitte der Gesellschaft angekommen ist und eine enorme gesellschaftliche Herausforderung darstellt.
Demenzformen
Der Begriff „Demenz“ stammt aus dem Lateinischen und bedeutet sinngemäß „ohne Geist“.
Demenz ist ein Oberbegriff für verschiedene Krankheitsbilder, die mit einem Verlust von kognitiven Fähigkeiten einhergehen. Bei einer Demenz kommt es zu einem Abbau geistiger Fähigkeiten mit Nachlassen des Gedächtnisses sowie anderer Leistungsbereiche des Gehirns.
Grundsätzlich unterscheidet man primäre und sekundäre Formen der Demenz. In ca. 90 % der Fälle handelt es sich um eine primäre Demenz. Primäre Demenzen haben ihren Ursprung im Gehirn und sind durch einen Untergang von Nervenzellen und/oder eine Erkrankung der Blutgefäße im Gehirn bedingt. Hierzu zählen insbesondere die Alzheimer-Demenz, die mit 60-80 % am häufigsten vorkommt, und die vaskuläre, d. h. gefäßbedingte Demenz mit einer Häufigkeit von 5-10 %. Zu den weiteren selteneren primären Demenzformen gehören u. a. die Lewy-Körper-Demenz und die frontotemporale Demenz (Morbus Pick) sowie Mischformen. Primäre Demenzen sind in der Regel nicht heilbar.
In etwa 10 % der Fälle liegt eine sekundäre Demenz vor. Hierbei entstehen die Symptome nicht primär durch den Verlust von Nervenzellen, sondern sie sind Folge einer anderen Grunderkrankung. Sekundäre Demenzen können beispielsweise durch Schilddrüsenerkrankungen oder Vitamin-B-12-Mangel verursacht sein oder auch im Rahmen von Depressionen auftreten. Sekundäre Demenzen können reversibel sein, wenn die Grunderkrankung erfolgreich behandelt werden kann.
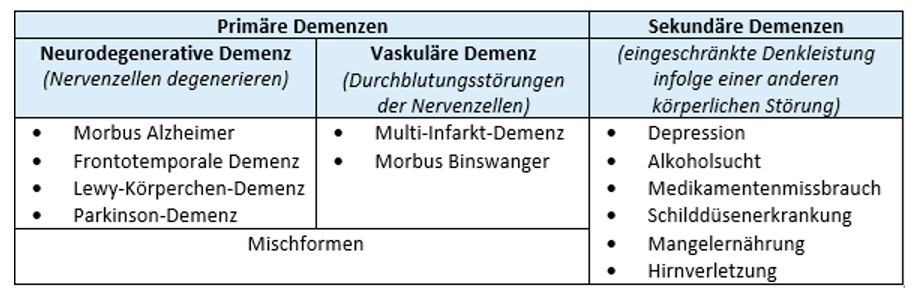
Abb. 1: Formen der Demenz
Epidemiologie
In Deutschland litten im Jahr 2021 - nach Schätzungen - fast 1,8 Millionen Menschen an Demenz, in der Altersgruppe ab 65 Jahren waren es nahezu 1,7 Millionen. Etwa 440.000 Menschen in der Altersgruppe ab 65 Jahre erkrankten neu an einer Demenz. Die Alzheimer-Demenz ist die häufigste Form. Rund zwei Drittel der Demenz-Erkrankten ist davon betroffen.
Prognosen zufolge könnte die Anzahl der Betroffenen (im Alter ab 65 Jahre) im Jahre 2030 auf bis zu 2 Millionen ansteigen, im Jahr 2040 auf bis zu 2,4 Millionen und im Jahr 2050 bis zu 2,8 Millionen erreichen.
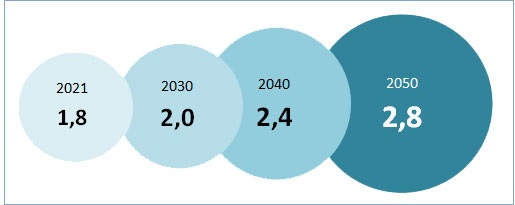
Abb. 2: Anzahl der Menschen mit Demenz in Deutschland (in Mio.)1
Derzeit wird geschätzt, dass weltweit im Jahr 2019 etwa 57 Millionen Menschen an Demenz erkrankt waren. Nach aktuellen Hochrechnungen könnte sich die Zahl der Betroffenen in den nächsten Jahrzehnten fast verdreifachen auf 152 Mio. Menschen in 2050.2
Veränderungen im Gehirn
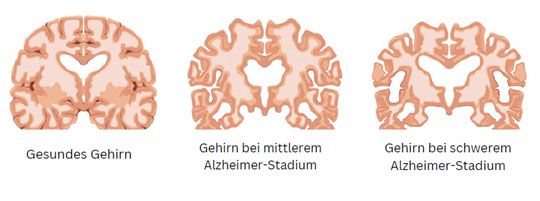
Bei der Alzheimer-Demenz kommt es zu krankhaften Veränderungen im Gehirn. In der Regel sind zunächst die Synapsen betroffen, so dass die Kommunikation zwischen den Neuronen nicht mehr richtig funktioniert und Informationen nicht mehr adäquat verarbeitet und weitergeleitet werden können. Zwei verschiedene Eiweißablagerungen spielen hier eine zentrale Rolle: das Tau-Protein und das Beta-Amyloid.
Tau-Proteine sind ein normaler Bestandteil im Inneren der Nervenzellen. Sie binden an die Mikrotubuli, stabilisieren sie und helfen so mit, dass der Transport in Zellen reibungslos läuft. Sie sind für die Stabilität und die Nährstoffversorgung der Zellen verantwortlich. Bei der Alzheimer-Erkrankung ist das Tau-Protein hingegen chemisch verändert, so dass es seine Funktion nicht mehr ausüben kann. Es löst sich stattdessen von den Mikrotubuli und bildet in den Nervenzellen Faserbündel, die sog. Tau-Fibrillen. Die Zellen verlieren ihre Form, ihre Funktion und zerfallen.
Amyloid ist ein natürlich im Körper vorkommendes Eiweiß, das im gesunden Gehirn problemlos gespalten und abgebaut wird. Bei der Alzheimer-Erkrankung verändert sich jedoch der Abbau des Amyloid-Vorläuferproteins, wodurch sog. Beta-Amyloid-Proteine entstehen, die vom Körper nicht mehr abgebaut werden können. Sie verklumpen und bilden unlösliche Ablagerungen zwischen den Nervenzellen, Amyloid-Plaques oder auch Alzheimer-Plaques genannt.
Beide Eiweiße, sowohl die Beta-Amyloid-Plaques als auch die Tau-Fibrillen, stören somit die Kommunikation in und zwischen den Nervenzellen und führen dadurch letzten Endes zu einem Absterben der Gehirnzellen mit der Folge, dass die geistigen Fähigkeiten Stück für Stück verloren gehen.
Symptome und Verlauf
Die Alzheimer-Krankheit geht mit einem Abbau des Gedächtnisses sowie kognitiver, emotionaler und sozialer Fähigkeiten einher. Der Krankheitsverlauf lässt sich in drei Phasen einteilen: die präklinische Phase, die Phase der leichten kognitiven Beeinträchtigung („mild cognitive impairment“, MCI) aufgrund der Alzheimer-Krankheit und die Phase der Alzheimer-Demenz. Das Stadium der Demenz lässt sich wiederum in die Stufen leicht, mittelschwer und schwer unterteilen, welche den Grad widerspiegeln, in dem die Symptome die Fähigkeit zur Ausübung von Alltagsaktivitäten beeinträchtigen.
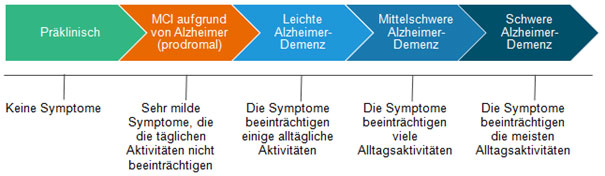
Abb. 3: Stadien der Alzheimer-Krankheit
In der präklinischen Phase weisen die Betroffenen lediglich messbare Hirnveränderungen auf, die auf die ersten Anzeichen der Alzheimer-Krankheit hinweisen, sie haben aber noch keine Symptome entwickelt.
In der Phase der leichten kognitiven Störung (MCI), können bereits leichte Einschränkungen auftreten, die beispielsweise eine höhere Anstrengung und Konzentration erfordern. Die Veränderungen fallen den Betroffenen und Angehörigen nur zum Teil auf, sind aber bereits in Gedächtnistests nachweisbar. Die Ausführung alltäglicher Aktivitäten ist jedoch noch nicht beeinträchtigt.
In den weiteren drei Stadien – leichte, mittelschwere und schwere Demenz – schreitet die Alzheimer-Erkrankung immer weiter voran.
Im frühen Stadium der Alzheimer-Demenz treten Störungen im Kurzzeitgedächtnis auf und den Betroffenen fällt es zunehmend schwer, sich in fremder Umgebung zu orientieren. Auch Reizbarkeit und Stimmungsschwankungen können auftreten. Die Betroffenen sind aber gewöhnlich noch in der Lage, in vielen Bereichen selbständig zu agieren, bei einigen Aktivitäten benötigen sie jedoch bereits Unterstützung.
Im mittleren Stadium ist meist auch das Langzeitgedächtnis betroffen, die Betroffenen vergessen immer mehr Ereignisse aus ihrem Leben und können unruhig und nervös werden. Sie beginnen, sich in ihrer Persönlichkeit und ihrem Verhalten zu verändern. Sie können Schwierigkeiten haben, sich mitzuteilen und Aufgaben des täglichen Lebens, zum Beispiel sich zu waschen und anzukleiden, zu bewältigen.
Im schweren Stadium der Alzheimer-Demenz benötigen die Betroffenen Hilfe bei den Aktivitäten des täglichen Lebens und müssen schließlich rund um die Uhr betreut werden. Die Betroffenen verlieren die Fähigkeit zu sprechen, zu sitzen und sich selbst zu bewegen. Aufgrund der Schädigung von Hirnregionen, die an der Bewegung beteiligt sind, werden die Betroffenen bettlägerig. Die Schädigung von Bereichen des Gehirns, die das Schlucken steuern, erschwert das Essen und Trinken, was dazu führen kann, dass Nahrungspartikel in die Lunge gelangen und zu einer Aspirationspneumonie führen.
Die Symptome der Alzheimer-Demenz schreiten meist langsam fort, sodass die Übergänge zwischen den verschiedenen Demenz-Stadien fließend sind. Ab Beginn der Symptome beträgt die durchschnittliche Lebenserwartung etwa sieben Jahre, der Krankheitsverlauf kann sich jedoch auch auf bis zu 20 Jahre erstrecken.
Diagnostik
Im Rahmen einer Demenz-Diagnostik finden zu Beginn ausführliche Anamnese-Gespräche zum allgemeinen Gesundheitszustand sowie eine körperliche Untersuchung mit Blutabnahme und Urinprobe statt, um andere Erkrankungen und Infektionen ausschließen zu können. Mit bildgebenden Verfahren, wie z. B. der Computertomographie (CT) oder der Magnetresonanztomographie (MRT) können zugrundeliegende Schlaganfälle, Durchblutungsstörungen oder Tumore als Ursache ausgeschlossen werden.
Sogenannte psychometrische Tests, zum Beispiel der Mini-Mental-Status-Test (MMST), der DemTect-Test sowie der Uhrentest, liefern Hinweise auf die Gedächtnisleistung und den Schweregrad eines möglichen kognitiven Defizits.
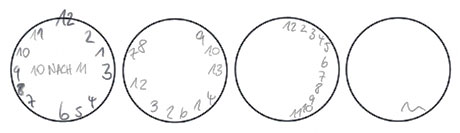
Abb. 4: Uhrentest: Beispiel für zunehmende visuell-räumliche Desorganisation bei fortschreitender Demenz
Neuere Verfahren wie die Single-Photon-Emissions-Computertomographie (SPECT) und die Positronen-Emissionstomographie (PET) können in unklaren Fällen und in Frühstadien zur Sicherung der Diagnose beitragen. Mit einer PET-Untersuchung kann z. B. ein verminderter Zuckerstoffwechsel im Gehirn festgestellt werden, obwohl im MRT noch keine Hirnatrophie nachweisbar ist. Auch ist es neuerdings möglich, die für die Alzheimer-Erkrankung typischen Amyloid-Ablagerungen darzustellen.
Eine weitere Methode zur Feststellung einer Alzheimer-Erkrankung ist die Untersuchung des Nervenwassers (Liquor). Im Liquor sind Korrelate neuropathologischer Veränderungen der Alzheimer-Krankheit messbar. Klinisch relevant sind: Beta-Amyloid-1-42, Gesamt-Tau und Phospho-Tau (p-Tau). Gemäß der aktuellen S3-Leitlinie sind Liquormarker jedoch immer im Kontext aller Befunde zu interpretieren und sollten nicht die Diagnose einer Alzheimer-Krankheit eigenständig begründen oder ausschließen.
Eine Alzheimer-Demenz wird gewöhnlich erst dann diagnostiziert, wenn bereits charakteristische Symptome wie Gedächtnisverlust vorliegen. Doch der eigentliche Beginn der Erkrankung liegt zu diesem Zeitpunkt schon weit zurück und die zugrundeliegenden Gehirnschädigungen sind bereits weit fortgeschritten und irreversibel.
Im Hinblick auf Vorbeugung und Behandlung ist es daher wichtig, die Erkrankung bereits in der symptomlosen Frühphase zu erkennen, wenn die ersten Veränderungen des Gehirns auftreten.
Früherkennung
Biomarker gelten als einer der vielversprechendsten Wege, das Risiko einer Alzheimer-Erkrankung bereits im symptomfreien Stadium zu erkennen. Es sind bereits mehrere Blut-Biomarker bekannt, deren Spiegel bei einer Alzheimer-Demenz charakteristischerweise ansteigen. Hierzu zählen p-Tau 181, das im Zuge der Alzheimer-Differenzialdiagnostik bestimmt wird, NfL (neurofilament light chain), ein Biomarker für Neurodegeneration, sowie das „saure Gliafaserprotein" GFAP, ein charakteristischer Zellbaustein in bestimmten Hirnzellen. In einer 2022 veröffentlichen prospektiven Längsschnitt-Kohortenstudie3, die über 17 Jahre verfolgt wurde, ergaben sich erstmals Hinweise, dass ein Anstieg der Konzentration von GFAP im Blut ein sehr früher Alzheimer-Risikofaktor sein könnte. Bei Menschen, die später an Alzheimer erkrankten, waren erhöhte GFAP-Spiegel im Blut bereits bis zu 17 Jahre vor der Diagnose nachweisbar, während erhöhte p-Tau 181- und NfL-Spiegel erst etwa neun Jahre vor der Manifestation feststellbar waren. Erhöhte p-Tau 181-Spiegel wurden bereits seit längerem als Alzheimer-Risikomarker diskutiert. Allerdings sind noch weitere und möglichst noch größere Studien erforderlich zur Klärung, wann genau die Konzentration dieses Markers messbar ansteigt, um einen möglichen Einsatz für die Früherkennung und Prävention bestmöglich zu bestimmen. Denkbar könnte eine mehrstufige Strategie zur Vorbeugung von Symptomen sein, bei der GFAP als erster Schritt auf die Notwendigkeit einer häufigeren Überwachung hinweist, während p-Tau 181 ein höheres Risiko für eine zukünftige klinische Alzheimer-Erkrankung anzeigen könnte.
Ergänzend zu den konzentrationsbasierten Protein-Biomarkern wird auch die Fehlfaltung von Beta-Amyloid in den Anfangsphasen der Erkrankung als strukturbasierter Biomarker erforscht. Eine weitere Untersuchung4 an den Probanden der oben genannten Studie zeigte, dass mit einem Immuno-Infrarot-Sensor, welcher die fehlgefalteten Proteinbiomarker im Blut erkennt, die später an Alzheimer erkrankten Personen mit einer präziseren Genauigkeit identifiziert werden konnten als mit der Messung der GFAP-Konzentration. Durch die Kombination von Beta-Amyloid-Fehlfaltung und GFAP-Konzentration erhöhte sich die Genauigkeit des Tests im symptomfreien Zustand weiter. Die Beta-Amyloid-Fehlfaltung und GFAP zeigten eine starke Fähigkeit zur Vorhersage des klinischen Alzheimer-Risikos und könnten daher wichtige frühe Alzheimer-Risikomarker sein.
Auch die Neurobildgebung gehört zu einem vielversprechenden Forschungsbereich, der sich mit der Früherkennung von Alzheimer- und anderen Demenzerkrankungen beschäftigt. Es wird erwartet, dass die Anwendung von Deep Learning und anderen KI-Methoden die Risikoerkennung beschleunigen wird.
Forscher der Universität Kaunas in Litauen5 haben eine auf Deep Learning basierende Methode entwickelt, die den möglichen Ausbruch der Alzheimer-Krankheit anhand von Gehirnbildern mit einer Genauigkeit von über 99 Prozent vorhersagen kann. Die Methode wurde durch die Analyse von funktionellen MRT-Bildern von 138 Probanden entwickelt und schnitt in Bezug auf Genauigkeit, Sensitivität und Spezifität besser ab als zuvor entwickelte Methoden.
Auch Gaubert et al.6 stellten 2021 ein maschinelles Lernverfahren zur Erkennung der präklinischen Alzheimer-Krankheit vor. Die Kombination aus demographischen und neuropsychologischen Daten, APOE4-Genotyp und Hippocampusvolumetrie sagte hierbei am stärksten Amyloid voraus und prognostizierte am besten eine Verschlechterung zum Prodromalstadium der Alzheimer-Krankheit nach fünf Jahren. Somit könnte maschinelles Lernen dazu beitragen, Patienten mit einem hohen Risiko für eine Alzheimer-Erkrankung mit Hilfe nicht-invasiver und erschwinglicher Biomarker zu untersuchen.
Behandlung
Auch wenn die Forschung auf Hochtouren läuft, ist eine Heilung der Alzheimer-Demenz bisher noch nicht möglich. Es gibt bisher lediglich symptomatische Behandlungsmaßnahmen, mit denen sich der Krankheitsverlauf abmildern und verlangsamen lässt.
Zur Behandlung der kognitiven Defizite (Gedächtnis, Merkfähigkeit) werden Antidementiva eingesetzt. Es gibt zwei Gruppen von Antidementiva: Acetylcholinesterase-Hemmer und Glutamat-Antagonisten.
Acetylcholin ist für die Signalübertragung von Nervenzelle zu Nervenzelle zuständig und somit für Gedächtnis und Aufmerksamkeit von zentraler Bedeutung. Durch den Nervenzellenuntergang entsteht bei der Alzheimer-Demenz ein Mangel dieses Botenstoffes im Gehirn. Acetylcholinesterase-Hemmer bewirken, dass der Abbau von Acetylcholin an der Synapse verzögert wird und führen dadurch zu einer besseren Signalübertragung zwischen den Nervenzellen. Die Denk- und Lernfähigkeit bleibt dadurch länger erhalten und der Verlauf der Erkrankung wird verlangsamt. Der Abbau an Nervenzellen wird jedoch nicht aufgehalten. Acetylcholinesterase-Hemmer sind zur Behandlung der leichten bis mittelschweren Alzheimer-Demenz zugelassen und in Gebrauch.
Auch der stimulierend wirkende Neurotransmitter Glutamat spielt bei der Alzheimer-Demenz eine wichtige Rolle. Beim gesunden Menschen sorgt Glutamat dafür, dass Lern- und Gedächtnisvorgänge stattfinden können. Durch eine anhaltend erhöhte Glutamatkonzentration im synaptischen Spalt werden die Nervenzellen jedoch dauererregt, wodurch die Signale nicht mehr richtig erkannt und weitergeleitet werden können, so dass die Nervenzelle der ständigen Überreizung schließlich nicht mehr standhalten kann, ihre Funktionsfähigkeit verliert und letztlich abstirbt. Der Glutamat-Antagonist Memantin wirkt der übermäßigen Glutamatausschüttung im Gehirn entgegen. Er wird zur Behandlung der moderaten bis schweren Alzheimer-Demenz eingesetzt, bei leichtgradiger Alzheimer-Demenz ist eine Wirksamkeit nicht belegt.
Darüber hinaus können auch hirnleistungsfördernde Wirkstoffe wie Ginko biloba eingesetzt werden. Die Ergebnislage zur Wirksamkeit wird jedoch als inkonsistent und nicht überzeugend bezüglich einer vorhersehbaren und klinisch relevanten Wirksamkeit bewertet.
Die Behandlung von begleitend auftretenden Störungen des Erlebens und Verhaltens, zum Beispiel Depressionen, Halluzinationen, Ängsten, Unruhe und Aggressivität, erfolgt mit Antidepressiva und Neuroleptika.
Darüber hinaus kommen auch nicht-medikamentöse Therapien, wie zum Beispiel Gedächtnistraining, Physiotherapie, Ergotherapie, Logopädie oder Verhaltenstherapie, bei der Behandlung der Alzheimer-Demenz zum Einsatz. Sie sind ebenfalls ein wichtiger Teil des Gesamtkonzepts. Ziel dieser Behandlungsformen ist es, die kognitiven Fähigkeiten zu trainieren oder aufrecht zu erhalten, die Alltagsfähigkeiten zu verbessern oder zu stabilisieren und das seelische Wohlbefinden zu fördern. Ebenso können sie schwierige Verhaltensweisen wie Unruhe oder Reizbarkeit eindämmen oder die körperliche Fitness verbessern. Zur nicht-medikamentösen Behandlung der Demenz gehört darüber hinaus auch die Unterstützung und Entlastung der Angehörigen.
In der medikamentösen Therapie der Alzheimer-Krankheit gibt es bisher keine Medikamente, die auf die grundlegenden Mechanismen der Erkrankung einwirken. Die heute zur Verfügung stehenden Medikamente und Therapien können bisher lediglich die Symptome der Alzheimer-Demenz lindern und dadurch den Verlauf etwas verlangsamen.
Das Ziel der Forschung ist, die Alzheimer-Krankheit ursächlich behandeln zu können und damit den Krankheitsverlauf insgesamt aufzuhalten. Derzeit zeichnen sich vielversprechende Entwicklungen hinsichtlich neuer medikamentöser krankheitsmodifizierender Therapieansätze ab. In den USA wurde 2023 ein neuartiges Medikament zur Behandlung von Alzheimer zugelassen: der Antikörper Lecanemab.
Lecanemab markiert das für die Alzheimer-Erkrankung charakteristische Beta Amyloid und vermittelt den Abbau des Amyloids durch das Immunsystem.
In einer im Januar 2023 veröffentlichten Studie7, welche 1795 an einer leichten Demenz erkrankte Personen umfasste, die über einen Zeitraum von 18 Monaten entweder mit Lecanemab oder einem Placebo behandelt wurden, konnte Lecanemab im Vergleich zur Kontrollgruppe die Amyloidmarker reduzieren und den Abbau der kognitiven Fähigkeiten um 27 Prozent verlangsamen.
Dieser Effekt ist zwar eher als moderat einzuschätzen und es ist zudem fraglich, wie stark dieser Effekt für die Betroffenen spürbar ist und tatsächlich im Alltag einen Unterschied macht, die Studie hat aber gezeigt, dass sich der verzögernde Effekt mit zunehmender Dauer der Wirkstoffeinnahme vergrößert hat. Die große Hoffnung ist daher, dass eine Einnahme über den Zeitraum der bisher untersuchten 18 Monate hinaus die Wirksamkeit von Lecanemab noch weiter verstärkt. Diesbezüglich sind weitere Studien erforderlich.
Auch die möglichen Nebenwirkungen führen zu Diskussionen. In der Studie sind bei 17 Prozent der Probanden lokale Hirnschwellungen und Mikroblutungen aufgetreten. In den meisten Fällen verliefen diese symptomlos, aber einige Erkrankte hatten einen schwerwiegenden Verlauf. Die Behandlung kann gravierende Nebenwirkungen haben. Daher ist eine engmaschige Kontrolle bei der Behandlung sehr wichtig.
Derzeit geht man davon aus, dass Lecanemab dieses Jahr auch in Europa zugelassen wird. Bei der Entscheidung wird die Abwägung von Nutzen und Nebenwirkungen eine große Rolle spielen.
Jedoch ist das Medikament lediglich für Patienten im ganz frühen Stadium geeignet, andernfalls sind die Schäden im Gehirn schon zu groß. Zudem kann das Mittel auch bestenfalls lediglich den Verlauf bremsen, ein Heilmittel ist es nicht.
Risikofaktoren und Prävention
Bisher ist es weder möglich, die Alzheimer-Demenz zu heilen noch ihr Fortschreiten aufzuhalten. Entscheidende Bedeutung haben daher Maßnahmen, die dazu beitragen, das Demenzrisiko zu senken.
„Es ist nie zu früh und nie zu spät im Leben für Maßnahmen zur Demenzprävention.“ Zu diesem Schluss kam die Lancet-Kommission in ihrem Report 20208.
Das Alter ist zwar der bedeutendste Risikofaktor für ein Nachlassen der kognitiven Funktionen, aber eine Demenz im hohen Alter ist nicht unvermeidlich. Es gibt Risikofaktoren, die modifizierbar, d. h. beeinflussbar sind. In jungen Jahren erhöht beispielsweise weniger Bildung das Risiko einer späteren Demenz. Im mittleren Lebensabschnitt sind vor allem beginnende Schwerhörigkeit und Rauchen gewichtige Faktoren. Relativ neu als Risikofaktoren anerkannt sind Kopfverletzungen, erhöhter Alkoholkonsum und Luftverschmutzung.
Die Lancet-Kommission für Demenzprävention, -intervention und -versorgung hatte bereits 2017 neun potenziell veränderbare Risikofaktoren für eine Demenzerkrankung identifiziert. Diese wurden inzwischen um drei weitere Faktoren ergänzt.
Zu den 12 modifizierbaren Risikofaktoren einer Demenz zählen demnach:
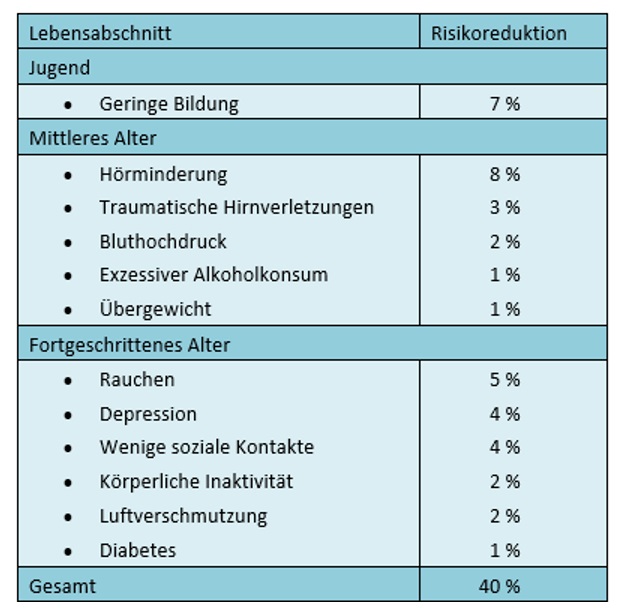
Laut den Erkenntnissen des Lancet-Reports sind diese 12 Risikofaktoren für 40 % der Demenzerkrankungen weltweit verantwortlich, die folglich theoretisch verhindert oder verzögert werden könnten, wenn es gelänge, die entsprechenden Risikofaktoren zu vermeiden oder effektiv zu behandeln.
Das individuelle Gesundheitsverhalten spielt somit eine entscheidende Rolle bei der Risikominderung. Insbesondere körperliche Bewegung, Ernährung und kardiovaskuläre Risikofaktoren, wie z. B. Bluthochdruck, Übergewicht und Rauchen, spielen somit nicht nur bei der Prävention von Herz-Kreislauferkrankungen eine große Rolle, sondern alles, was Herz-Kreislauferkrankungen vorbeugt, senkt auch gleichzeitig das Risiko, an Demenz zu erkranken.
Auswirkungen auf die Versicherungsbranche
Insbesondere Lebensversicherungen und Pflegeversicherungen decken das Risiko einer Alzheimer- oder anderen Demenzerkrankung ab. Schätzungen gehen, wie oben dargestellt, davon aus, dass sich die Zahl der an Demenz Erkrankten in Deutschland von 1,8 Mio. im Jahre 2021 auf bis zu 2,8 Mio. im Jahre 2050 erhöhen könnte. Neben den Auswirkungen auf die Sterblichkeit wird auch der Anstieg der mit der Pflege und Behandlung verbundenen Kosten für die Versicherer erheblich sein.
Im Jahr 2019 waren Alzheimer- und andere Demenzerkrankungen bereits die siebthäufigste Todesursache weltweit. In Deutschland gingen im Jahr 2021 rund fünf Prozent aller Todesfälle auf Demenzerkrankungen zurück.
Den Ergebnissen einer Metaanalyse9 zufolge werden die Kosten für Demenz in Deutschland für das Jahr 2020 mit rund 83 Milliarden Euro beziffert, nach Prognosen könnten diese Kosten im Jahr 2040 auf rund 141 Milliarden Euro, im Jahr 2060 auf rund 195 Milliarden Euro anwachsen. Hierbei wurden die „gesamtgesellschaftlichen Kosten“ erfasst, welche sowohl die Kosten der Kranken- und Pflegekassen als auch die Kosten der „informellen“ Pflege beziehungsweise den Gegenwert dieser unbezahlten Tätigkeit, die insbesondere durch Angehörige geleistet wird, umfassen.
Die Demenz stellt eine erhebliche gesellschaftliche und finanzielle Herausforderung dar. Ohne kurative Therapien sind präventive Maßnahmen, Interventionen zum Erhalt der körperlichen und kognitiven Fähigkeiten sowie die Angehörigenunterstützung unabdingbar, um dem Kostenanstieg entgegenzuwirken.
Wenn sich dieser negative Trend durch Fortschritte bei der Heilung und Behandlung in Verbindung mit verstärkten Präventionsbemühungen aufhalten oder sogar umkehren ließe, wäre dies nicht nur für die Versicherungsbranche, sondern auch für die Gesellschaft von großem Vorteil.
Quellen:
1 Deutsche Alzheimer Gesellschaft e.V., Informationsblatt 1, Die Häufigkeit von Demenzerkrankungen, August 2022
2 GBD 2019 Dementia Forecasting Collaborators. Estimation of the global prevalence of dementia in 2019 and forecasted prevalence in 2050: an analysis for the Global Burden of Disease Study 2019. Lancet Public Health. 2022; 7: e105–25.
3 Stocker H, Beyer L, Perna L, et al., Association of plasma biomarkers, p-tau181, glial fibrillary acidic protein, and neurofilament light, with intermediate and long-term clinical Alzheimer’s disease risk: Results from a prospective cohort followed over 17 years. Alzheimer’s Dement. 2023;19:25-35.
4 Beyer L, Stocker H, Rujescu D, et al. Amyloid-beta misfolding and GFAP predict risk of clinical Alzheimer’s disease diagnosis within 17 years. Alzheimer’s Dement. 2023;19:1020-1028.
5 Odusami, M.; Maskeliūnas, R.; Damaševičius, R.; Krilavičius, T. Analysis of Features of Alzheimer’s Disease: Detection of Early Stage from Functional Brain Changes in Magnetic Resonance Images Using a Finetuned ResNet18 Network. Diagnostics 2021, 11, 1071.
6 Gaubert S, Houot M, Raimondo F, Ansart M, Corsi MC, Naccache L, Sitt JD, Habert MO, Dubois B, De Vico Fallani F, Durrleman S, Epelbaum S; INSIGHT-preAD study group. A machine learning approach to screen for preclinical Alzheimer's disease. Neurobiol Aging. 2021 Sep;105:205-216.
7 van Dyck CH, Swanson CJ, Aisen P et al (2023) Lecanemab in early Alzheimer’s disease. N Engl J Med 388:9–21
8 Livingston, G., Huntley, J., Sommerlad, A., Ames, D., Ballard C, Banerjee, S., Brayne, C., Burns, A., Cohen-Mansfield, J., Cooper, C., Costafreda, S., G., Dias, A., Fox, N., Gitlin, L., N., Howard, R., Kales, H.,C., Kivimäki, M., Larson, E., B., Ogunniyi, A., Orgeta, V., Ritchie, K., Rockwood, K., Sampson, E., L., Samus, Q., Schneider, L., S., Selbæk, G., Teri, L., Mukadam, N.. 2020. Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet. 396(10248), 413-446.
9 Michalowsky, B., Kaczynski, A. & Hoffmann, W. Ökonomische und gesellschaftliche Herausforderungen der Demenz in Deutschland – Eine Metaanalyse. Bundesgesundheitsbl 62, 981–992 (2019)